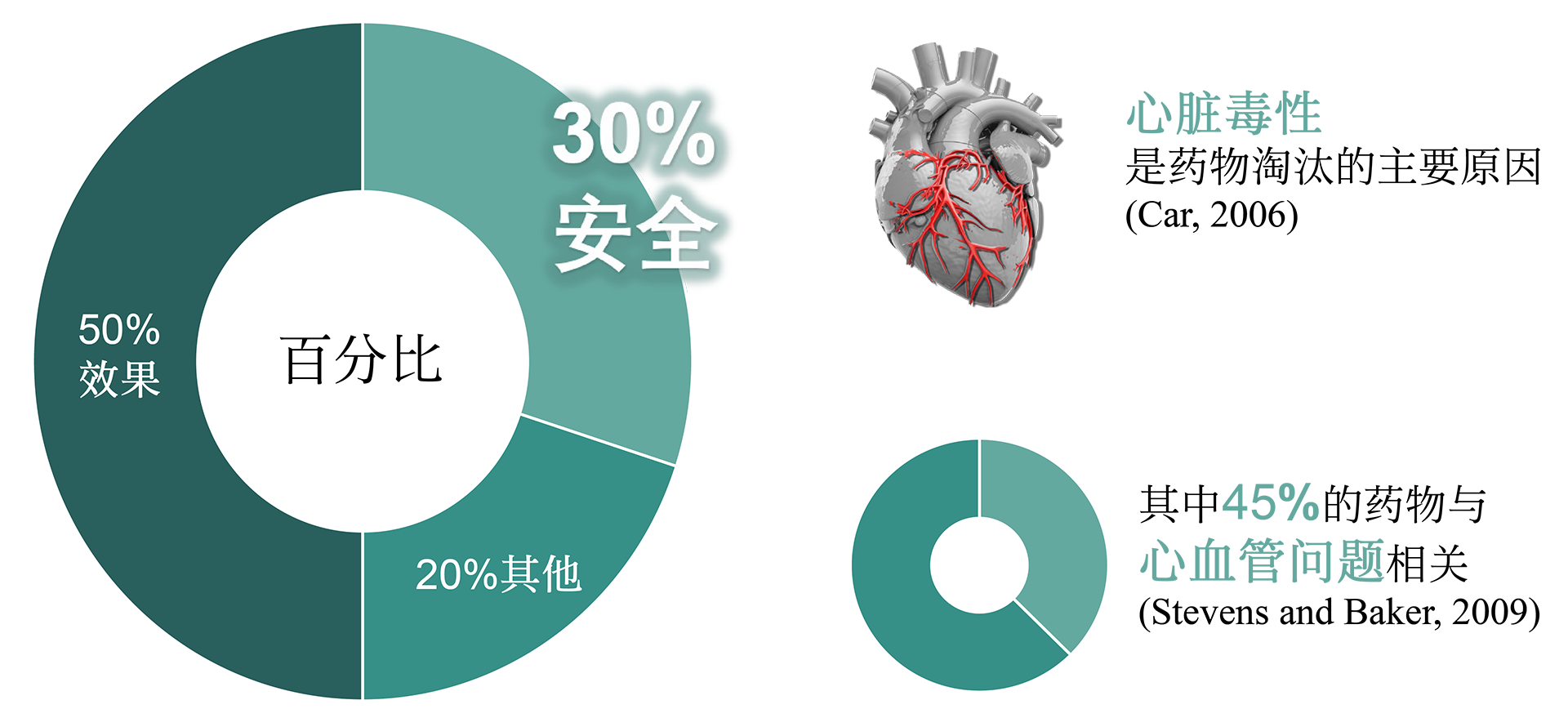
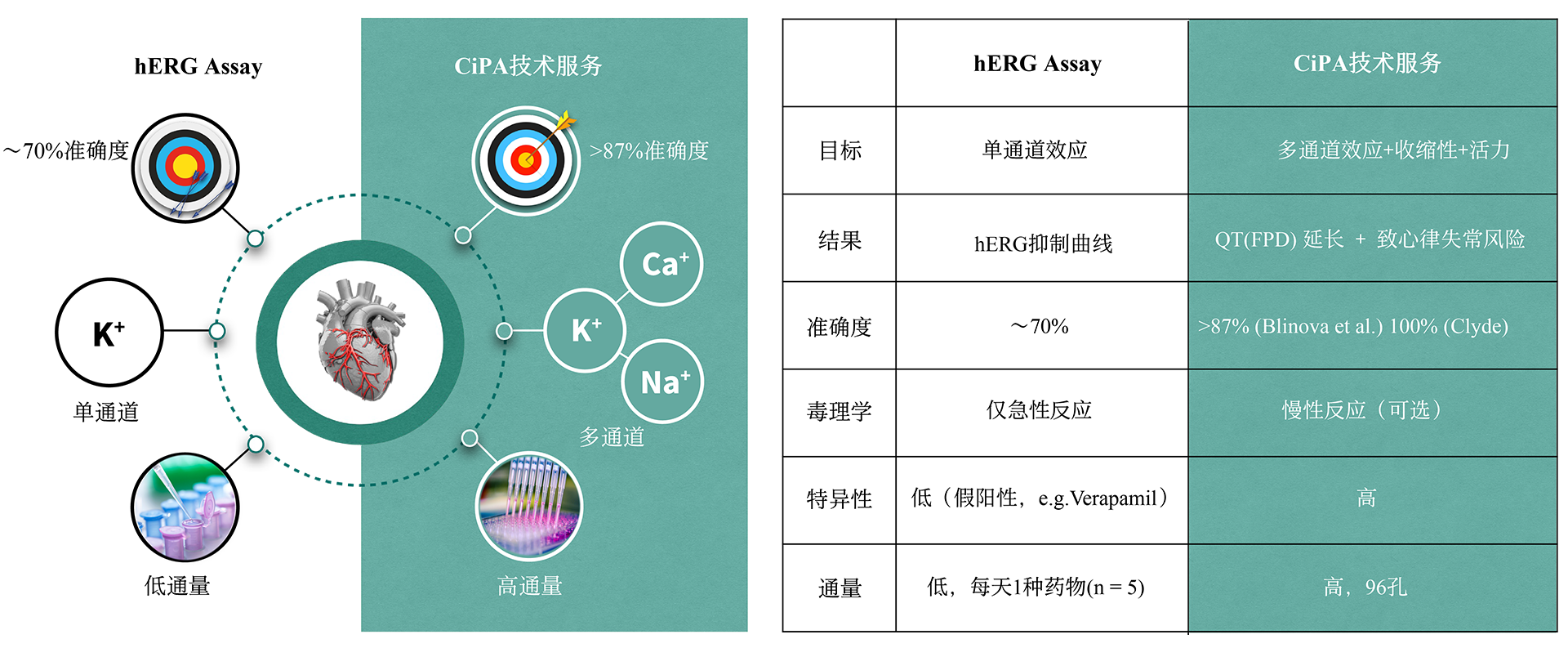
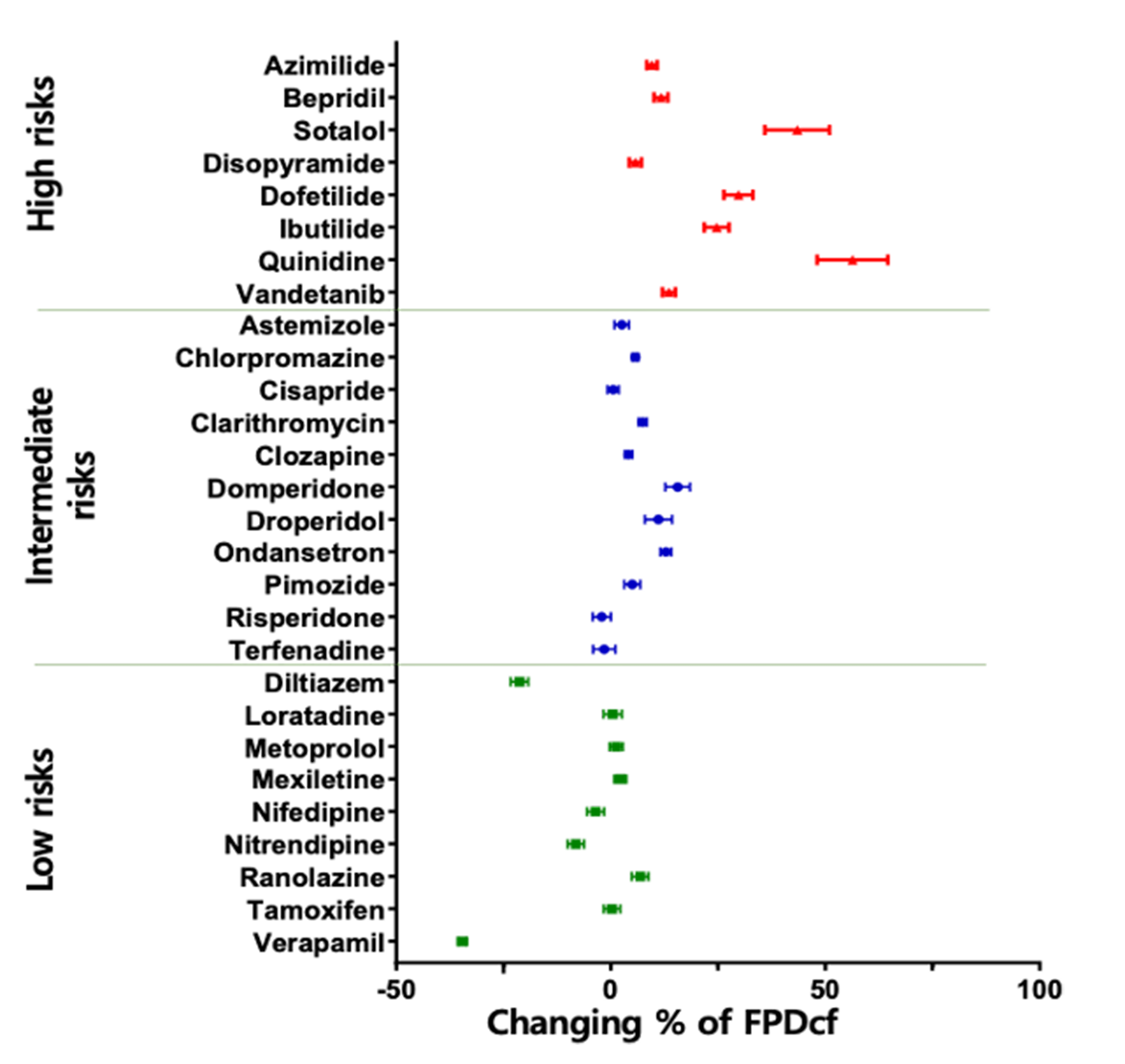
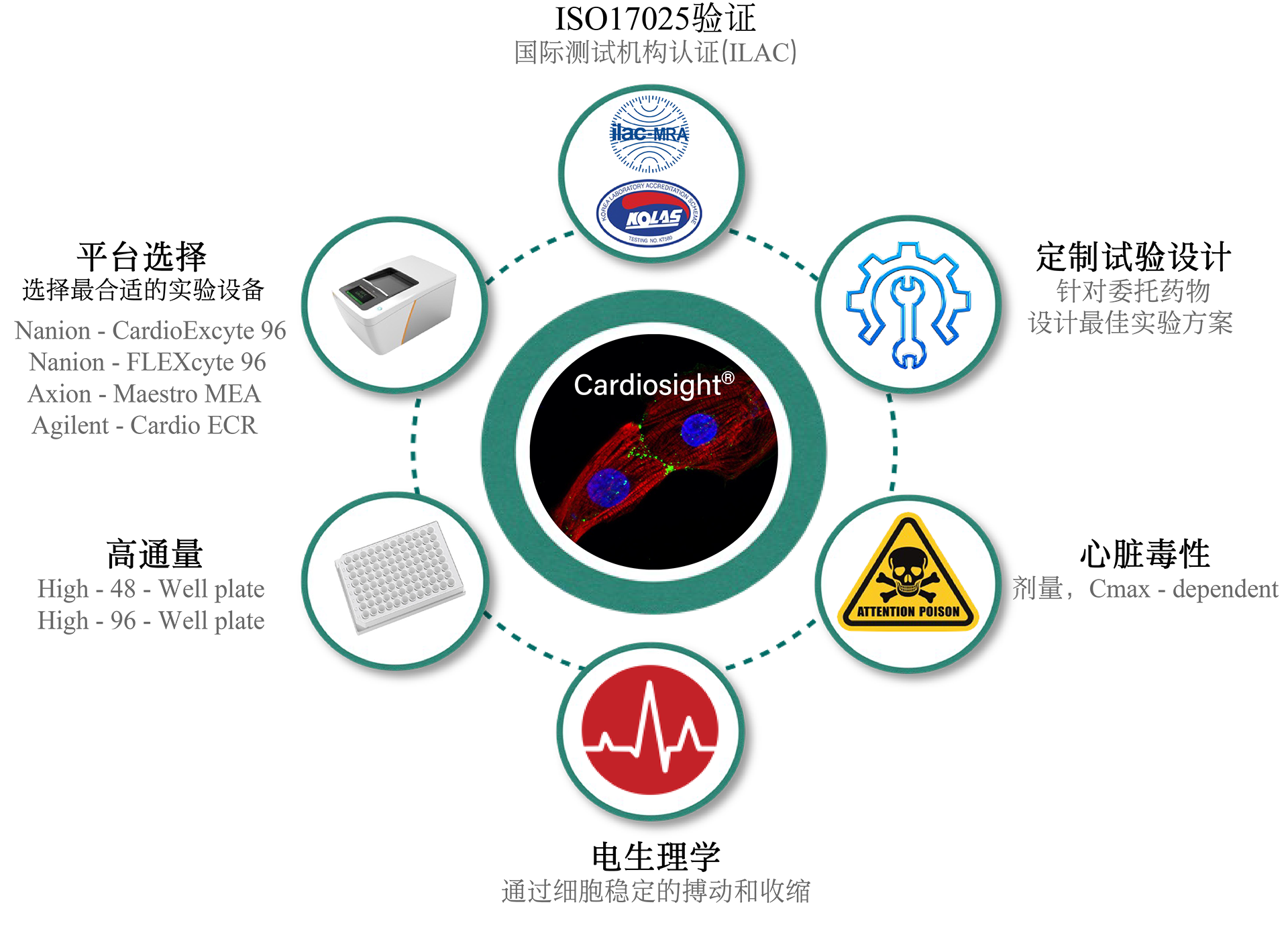
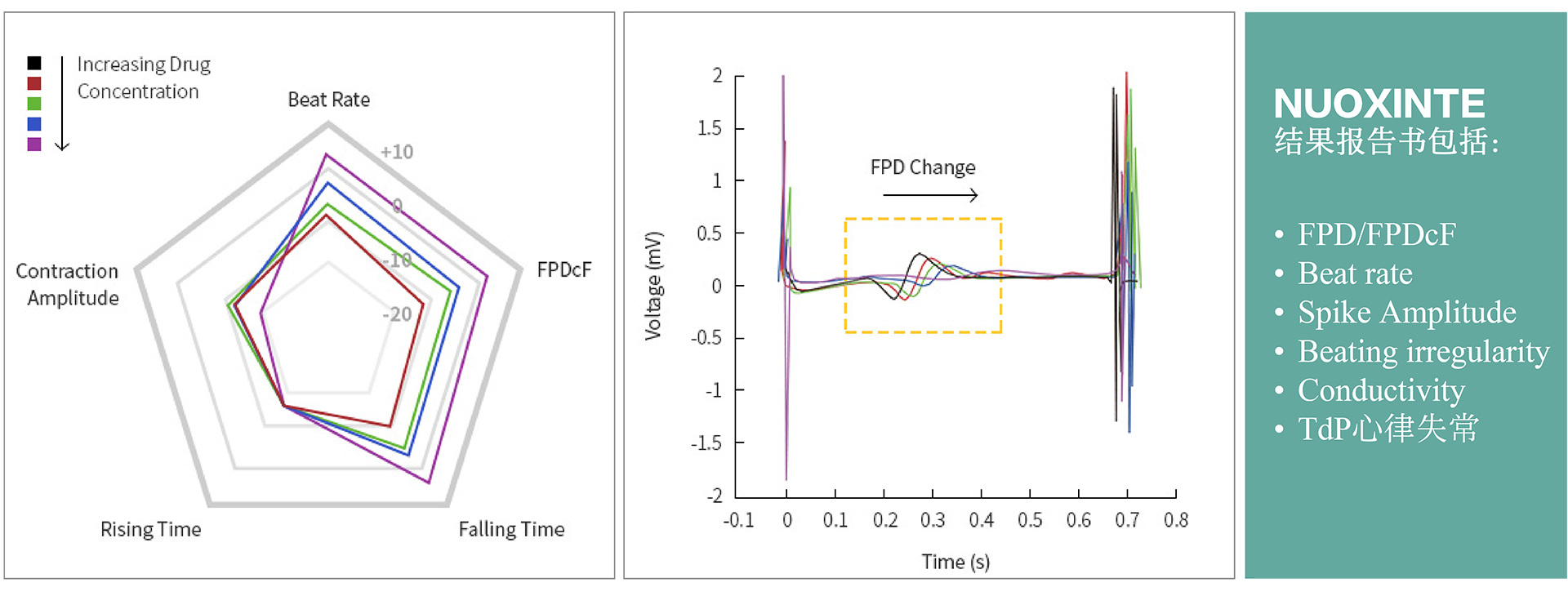
诺欣特生物的心脏安全性CiPA技术服务可以帮助新药研发公司预测和评估药物诱发心脏心律失常的可能性,使其做出有效的决策。药物引起的心律失常(尖端扭转性室性心动过速, TdP)不良反应是新药终止研发或撤出市场的最主要原因之一。目前,hERG assay作为评价药物致心律失常毒性的主要手段,其敏感性和特异性存在诸多问题。因此,US FDA, CSRC, HESI 和SPS等机构提出有关临床前药物心脏安全评估的新建议-综合性离体致心律失常风险评价 (CiPA , Comprehensive In Vitro Proarrhythmia Assay)。 CiPA于2022年2月被ICH写入新指导原则ICH E14/S7B,于2023年7月在中国落地实施。公司作为HESI成员之一,参与了新指导原则的修订,研发了CiPA检测中至关重要的iPS衍生心肌细胞(iPSC-CM)-Cardiosight®,创建了新的心脏安全性检测方法,并获得国际ISO17025认证。诺欣特生物利用自研的Cardiosight®产品提供心脏安全性CiPA技术服务,在试验设计和成本方面具有较大的优势,可根据最新标准,提供最准确的结果。了解相关详细信息,请与我们联系。